Reaksi-Reaksi Spesifik Pada Protein
REAKSI-REAKSI
SPESIFIK PADA PROTEIN
Nah…. Kembali lagi pada
postingan berikutnya, kali pada postingan ini akan dibahas mengenai “Reaksi-reaksi Spesifik pada Protein”. Sebelum
memahami lebih lanjut mengenai reaksi-reaksi spesifik pada protein, terlebih
dahulu kita harus mengetahui apa yang dimaksud dengan protein itu sendiri. Pada
dasarnya yang dimaksud dengan Protein adalah
suatu
senyawa organik yang mempunyai ikatan peptida dan berasal dari monomer asam
amino.Kata protein merupakan kata yang berasal dari bahasa Yunani, yaitu Protos dan memiliki arti “yang paling
utama”. Dalam hal ini perlu diketahui bahwasannya apabila organisme sedang
kekurangan energy, maka protein ini dapat digunakan sebagai sumber energy. Kandungan
energy protein rata-rata 4 kkal/gram atau setara dengan energy rata-rata yang
dimiliki oleh karbohidrat. Perlu ditegaskan bahwasannya seluruh sel makhluk
hidup mendapatkan manfaat penting dari protein ini, oleh karena itu hal ini tentunya
punya penyebab, yaitu karena protein mengandung karbon, sulfur, nitrogen,
hidrogen dan oksigen. Protein
juga mengandung fosfor.
Banyak protein mengandung zat- zat
lain disamping asam amino, maka struktur 3 dimensi dan banyak sifat biologi
protein ditentukan terutama oleh jenis asam amino berikatan satu sama lain pada
rantai polipeptida dari hubungan keruangan satu asam amino dengan yang lain.
Sifat biologi protein yang unik terutama disebabkan oleh interaksi spesifik
antara asam amino yang menyusunnya. Pada dasarnya yang dimaksud dengan asam
amino adalah asam
karboksilat yang mempunyai gugus amino, mempunyai rumus dasar R-CHNH2COOH
dimana R adalah gugus rantai samping. Asam amino merupakan monomer
pembentuk protein, mempunyai peranan penting dalam metabolisme sel
hidup. Adanya gugus rantai samping tersebut menyebabkan sifat
berbeda antara asam-asam amino dan juga berbedanya sifat
protein. Gugus amino asam amino dan gugus karboksil memperlihatkan
semua reaksi yang dapat diharapkan dari fungsi ini, misalnya pembentukan garam,
pengesteran, dan asilasi. Gugus rantai samping juga menghasilkan
reaksi spesifik dengan pereaksi tertentu. Oleh karena itu, pada dasarnya
protein memiliki beberapa reaksi spesifik asam amino dengan pereaksi ninhidrin,
Hopkins-Cole, dan garam nitroprussida.
Perlu
diketahui bahwasannya Reaksi
Adamkiewitz-Hopkins adalah suatu reaksi untuk menentukan gugus indole
spesifik untuk asam amino triptofan. Senyawa-senyawa indolik dengan aldehid
tertentu (asam glioksilik, metanol, para metil amino-benzaldehide) dalam
suasana asam dan dingin memberikan warna violet.
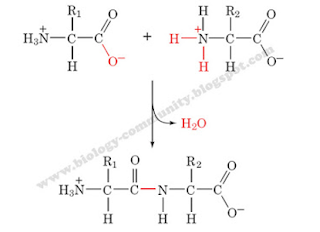
Seperti yang telah dijelaskan diatas
bahwasannya Protein merupakan polimer
yang tersusun dari asam amino sebagai monomernya. Monomer-monomer ini tersambung dengan ikatan peptida, yang mengikat gugus karboksil milik
satu monomer dengan gugus amina milik monomer di sebelahnya. Reaksi
penyambungan ini (disebut translasi)
secara alami terjadi di sitoplasma dengan bantuan ribosom dan tRNA. Pada
polimerisasi asam amino, gugus -OH yang merupakan bagian gugus karboksil satu
asam amino dan gugus -H yang merupakan bagian gugus amina asam amino lainnya
akan terlepas dan membentuk air. Oleh sebab itu, reaksi ini termasuk dalam reaksi dehidrasi. Molekul asam amino yang telah melepaskan
molekul air dikatakan disebut dalam bentuk residu asam amino. Berikut ini merupakan gambaran mengenai dua asam amino
yang akan menghasilkan ikatan peptide, yaitu sebagai berikut :
STRUKTUR DARI PROTEIN
Protein tersusun dari peptida-peptida sehingga membentuk
suatu polimer yang disebut polipeptida. Setiap monomernya tersusun atas suatu
asam amino. Asam amino adalah molekul organik yang memiliki gugus karboksil dan
gugus amino yang mana pada bagian pusat asam amino terdapat suatu atom karbon
asimetrik (Gambar 1). Pada keempat pasangannya yang berbeda itu adalah gugus
amino, gugus karboksil, atom hidrogen, dan berbagai gugus yang disimbolkan
dengan huruf R. Gugus R disebut juga sebagai Rantai samping yang berbeda dengan
gugus amino. Pada dasarnya bentuk umum dari struktur protein adalah
sebagai berikut :
Dibawah ini
akan dijelaskan mengenai pembagian struktur dari protein, yaitu dapat dilihat
seperti dibawah ini :
1)
Struktur Primer
Struktur primer
terkait mengenai terbentuknya rantai-rantai dengan ikatan-ikatan peptida dimana jumlah, macam, dan cara terkaitnya (urutan)
asam-asam amino mempunyai peranan penting. Struktur primer dari protein dapat
dilihat pada gambar berikut ini, yaitu :
1)
Struktur Sekunder
Pada dasarnya sruktur sekunder merupakan kombinasi antara struktur
primer yang linear distabilkan oleh ikatan hidrogen antara gugus =CO dan =NH di
sepanjang tulang belakang polipeptida. Salah satu contoh struktur sekunder
adalah α-heliks dan β-pleated (Gambar 5 dan 6). Struktur ini memiliki
segmen-segmen dalam polipeptida yang terlilit atau terlipat secara berulang, atau dapat
dikatakan bahwa yang dimaksud dengan struktur sekunder pada protein adalah struktur yang terkait
mengenai berlilitnya rantai-rantai
polipeptida sampai terbentuknya suatu
struktur spiral karena terjadi ikatan hidrogen.
Berikut
ini merupakan bentuk atau struktur dari struktur sekunder protein, yaitu
sebgaai berikut :
Struktur α-heliks terbentuk
antara masing-masing atom oksigen karbonil pada suatu ikatan peptida dengan
hidrogen yang melekat ke gugus amida pada suatu ikatan peptida empat residu
asam amino di sepanjang rantai polipeptida (Murray et al, 2009).
Pada struktur sekunder
β-pleated terbentuk melalui ikatan hidrogen antara daerah linear rantai
polipeptida. β-pleated ditemukan dua macam bentuk, yakni antipararel dan
pararel (Gambar 7 dan 8). Keduanya berbeda dalam hal pola ikatan hidrogennya.
Pada bentuk konformasi antipararel memiliki konformasi ikatan sebesar 7 Å,
sementara konformasi pada bentuk pararel lebih pendek yaitu 6,5 Å
(Lehninger et al, 2004). Jika ikatan hidrogen ini dapat terbentuk
antara dua rantai polipeptida yang terpisah atau antara dua daerah pada sebuah
rantai tunggal yang melipat sendiri yang melibatkan empat struktur asam amino,
maka dikenal dengan istilah β turn yang ditunjukkan dalam Gambar 9
(Murray et al, 2009).
1)
Struktur Tersier
Struktur tersier dari suatu protein adalah lapisan yang tumpang tindih di atas
pola struktur sekunder yang terdiri atas pemutarbalikan tak beraturan dari
ikatan antara rantai samping (gugus R) berbagai asam amino (Gambar 10).
Struktur ini merupakan konformasi tiga dimensi yang mengacu pada hubungan
spasial antar struktur sekunder. Struktur ini distabilkan oleh empat macam
ikatan, yakni ikatan hidrogen, ikatan ionik, ikatan kovalen, dan ikatan
hidrofobik. Dalam struktur ini, ikatan hidrofobik sangat penting bagi protein.
Asam amino yang memiliki sifat hidrofobik akan berikatan di bagian dalam
protein globuler yang tidak berikatan dengan air, sementara asam amino yang
bersifat hodrofilik secara umum akan berada di sisi permukaan luar yang
berikatan dengan air di sekelilingnya (Murray et
al, 2009; Lehninger et al, 2004).
Berikut ini akan diberikan contoh gambar dari struktur tersier pada protein,
yaitu :
1)
Struktur Kuarterner
Struktur kuarterner adalah gambaran dari pengaturan sub-unit atau promoter
protein dalam ruang. Struktur ini memiliki dua atau lebih dari sub-unit protein
dengan struktur tersier yang akan membentuk protein kompleks yang fungsional.
ikatan yang berperan dalam struktur ini adalah ikatan nonkovalen, yakni
interaksi elektrostatis, hidrogen, dan hidrofobik. Protein dengan struktur
kuarterner sering disebut juga dengan protein multimerik. Jika protein yang
tersusun dari dua sub-unit disebut dengan protein dimerik dan jika tersusun
dari empat sub-unit disebut dengan protein tetramerik (Gambar 11) (Lodish et al., 2003; Murray et al, 2009). Berikut ini
merupakan gambar dari struktur kuarterner dari protein, yaitu sebagai berikut :
CIRI-CIRI MOLEKUL PROTEIN
Adapun ciri-ciri dari molekul protein dapat dilihat
berdasarkan coro-ciri protein berikut ini, yaitu :
a)
Berat molekulnya besar, ribuan bahkan sampai jutaan,
sehingga merupakan makromolekul.
b)
Umumnya terdiri dari 20 asam amino.Asam amino berikatan
secara kovalen satu dengan yang lainnya dalam variasi urutan-urutan yang
bermacam-macam, membentuk suatu rantai polipeptida. Ikatan peptida merupakan
ikatan gugus karboksil dari asam amino yang satu dengan asam amino lainnya.
c)
Terdapatnya ikatan kimia lain yang menyebabkan terbentuknya
lengkungan-lengkungan rantai polipeptida menjadi struktur 3 dimensi protein.
Sebagai contoh ikatan hidrogen, ikatan hidrofob/ikatan apolar, ikatan ion atau
ikatan elektrostatik dan ikatan Van der Waals.
d)
Strukturnya tidak stabil terhadap beberapa faktor
seperti: pH, radiasi, temperatur, dan medium pelarut.
e)
Umumnya reaktif dan sangat spesifik, disebabkan
terdapatnya gugus samping yang reaktif dan susunan khas struktur molekulnya.
f)
Beraksi positif terhadap pereaksi uji-uji yang spesifik
seperti: Biuret, Ninhidrin dan Millon, Xantoprotein, Sakaguchi, Adamkiewitz.
Pada dasarnya Bila
asam amino dalam makanan malampaui kebutuhan untuk sintesis protein dan
lintasan anabolik lainnya. Kelebihannya dikatabolisme untuk menentukan ATP atau
diubah menjadi substrak untuk sintesis asam lemak. Protein selular mengalami
“turn over” (dipecahkan dan diganti kembali) dengan kecepatan sekitar 400
gr/hari pada orang dewasa. Melalui suatu proses tertentu sejumlah asam amino
dapat membentuk suatu senyawa yang memiliki banyak ikatan peptida. Molekul
senyawa ini merupakan suatu molekul besar atau makromolekul yang terdiri atas
banyak molekul asam amino yang disebut juga sebagai polipeptida. Ada beberapa
analisis asam amino, misalnya metode gravitrimetri, kalorimetri, mikrobiologi,
kromatografi dan elekrofotolisis. Salah satu metode yang banyak digunakan dan
memperoleh perkembangan adalah metode kromatografi. Konsumsi protein diperlukan
untuk sumber nitrogen dalam tubuh, pembentukan zat-zat yang mengandung N (nitrogenous)
dan sebagai sumber asam amino esensial yang tidak dapat dibentuk di dalam tubuh
atau hanya dalam jumlah kecil saja untuk mensuplai kebutuhan sehari-hari.
Hampir semua nitrogen dari katabolisme protein asam amino secara normal hilang
dalam bentuk urea melalui ekskresi urine walaupun jumlahnya terbuang dalam
bentuk NH4+ dan keratin. Gangguan metabolisme asam
amino ditandai oleh kadar asam amino atau produk metaboliknya yang abnormal
dalam darah dan urine. Gangguan dalam metabolisme asam amino sering menyebabkan
retardasi mental dan gangguan perkembangan (Linder, 1985).
ANALISIS PROTEIN
Berikut
ini akan dijelaskan reaksi-reaksi untuk mengidentifikasi asam amino dan
protein, yaitu sebagai berikut :
a) Reaksi Sakaguci
Pada dasarnya pengujian reaksi asam amino dan protein
dengan Reaksi Sakaguci merupakan suatu
reaksi dimana reaksi ini dilakukan dengan menggunakan
pereaksi nafol dan natrium hipobromit. Pada dasarnya reaksi ini dapat memberi
hasil positif apabila ada gugus guanidin. Jadi arginin atau protein yang
mengandung arginin dapat menghasilkan warna merah.
b)
Reaksi Xantoprotein
Pada dasarnya reaksi ini dilakukan dengan cara menambahakan
larutan asam nitrat pecan kedalam latutan protein. Setelah dicampur terjadi
endapan putih yang dapat berubah menjadi kuning apabila dipanaskan. Reaksi yang
terjadi adalah nitrasi pada inti benzena yang terdapat pada molekul protein.
Jadi reaksi ini positif jika mengandung tirosin, fenil alanin dan triptofan.
c)
Reaksi
Hopkins-Cole
Pada dasarnya triptofan
dapat berkondensasi dengan beberapa aldehida dengan bantuan asam kuat dan
membentuk senyawa yang berwarna. Larutan protein yang mengandung triptofan
dapat direasikan dengan pereaksi Hopkins-Cole yang mengandung asam glioksilat..
Setelah dicampur dengan pereaksi Hopkins - Cole,
asam sulfat dituangkan perlahan-lahan sehingga membentuk lapisan di bawah
larutan protein. Beberapa saat kemudian akan terjadi cincin ungu pada batas
antara kedua lapisan. Reaksi Hopkins-Cole memberi hasil positif khas untuk
gugus indol dalam protein.
d)
Reaksi Millon
Pada dasarnya reaksi
millon ini dilakukan dengan cara menambahakan pereaksi millon kedalam larutan
protein. Pada dasarnya pereaksi millon dibuat dengan cara mencampurkan larutan
merkuro dan merkuri nitrat dalam asam nitrat. Hasil pencampuran akan
menghasilkan endapan putih yang dapat berubah menjadi merah oleh pemanasan. Pada
dasarnya reaksi ini positif untuk feno;-fenol, karena terbentuknya senyawa
merkuri dengan gugus hidroksifenil yang berwarna.
e)
Reaksi NatriumNitroPrusida
Pada dasarnya reaksi NatriumNitroPrusida
dalam larutan amoniak akan menghasilkan warna merah dengan protein yang
mempunyai gugus –SH bebas. Sehingga protein yang mengandung sistein dapat
memberikan hasil positif jika direaksikan dengan larutan asam amino dan
protein.
f)
Metode Buret
Dalam melakukan
pengujian terhadap larutan asam amino dan protein ini dapat di lakuan dengan
metode sederhana yakni, Metode Buret. Dalam hal ini metode buret dilakukan
dengan cara membuat alkalis larutan protein dengan NaOH kemudian ditambahkan
CuSO4 enver. Pada dasarnya pengujian ini dilakukan untuk menunjukkan
adanya senyawa-senyawa yang mengandung gugus amida asam yang berada bersama
gugus amida yang lain. Uji ini memberikan reaksi positif yaitu ditandai dnegan
timbulnya warna violet atau biru violet pada larutan yang akan diuji.
PERMASALAHAN
1)
Coba saudara
jelaskan dengan singkat bagaimana pembentukan ikatan peptide yang terjadi pada
asam amino dan protein serta jelaskan prosesnya!
2)
Jelaskan dengan
singkat apa yang dimaksud dengan triptofan? Dan jelaskna stuktur yang terdapat
pada triptofan ini!
3)
Jelaskan dengan
singkat bagaimana proses terbentuknya stuktur sekunder α-heliks dan β-pleated ?
4)
Jelaskan menurut pendapat anda bagaimana jika seseorang
kelebihan protein dalam tubuh? Dan apa upaya yang hars dilakukan jika protein
dalam tubuh sudah berlebih ?








Saya akan menjawab pertanyaan nomor 4 1.Kelebihan berat badan
BalasHapusProtein memang membantu tubuh agar tetap sehat, tetapi akan beresiko kelebihan berat badan ketika melebihi jumlah maksimal. Di dalam 1 gram protein terdapat 4 kalori, artinya jumlah kalori akan meningkat meskipun mendapatkan jumlah protein yang sedikit. Dengan asupan yang cukup akan membuat tubuh lebih baik daripada kelebihan protein. Apabila tubuh mendapatkan jumlah protein yang berlebihan berat badan akan meningkat dan dapat mengganggu organ-organ lainnya. Imbangi konsumsi protein dengan makanan lainnya yang tidak mengandung protein. Konsumsi makanan yang mengandung banyak serat seperti buah atau sayur untuk menjaga berat badan tetap stabil.
2.Merusak hati dan otak
Kelebihan protein mungkin terlalu sepele, tetapi dampak yang dapat terjadi dalam jangka panjang juga sangat berbahaya. Tubuh yang memiliki kelebihan protein akan menganggu kinerja hati dan otak. Protein yang berlebihan bukan membuat tubuh menghasilkan zat-zat yang baik untuk tubuh, tetapi justru membentuk racun dan mengganggu kinerja hati. Selanjutnya, racun tersebut akan menumpuk di dalam hati karena proses perubahan zat terjadi di hati. Apabila hati sudah terlalu banyak menampung racun, otomatis akan menganggu peredaran darah. Hati yang sangat berperan penting dalam proses aliran darah akan membuat aliran darah juga mengalami masalah. Apabila tidak ditangani secepatnya, saraf otak juga akan mendapatkan dampaknya.
3.Dll
Jika protein berlebih maka Seimbangkan dengan buah sayur untuk melengkapi jumlah vitamin dan mineral lainnya di dalam tubuh.
saya akan menjawab no.2
BalasHapusTriptofan (Tryptophan) merupakan salah satu jenis asam amino esensial yang dibutuhkan untuk perkembangan dan pertumbuhan tubuh secara umum, produksi niacin, dan menciptakan seratonin dalam tubuh. Seratonin diduga dapat membuat tidur kita lebih nyaman dan dapat membuat suasana hati menjadi lebih stabil. Triptofan dapat kita temukan dalam beberapa jenis makanan yang mengandung protein.
Triptofan (Tryptophan) adalah jenis asam amino yang tidak dapat diproduksi oleh tubuh
strukturnya berisi indole fungsional group, yang berarti itu tidak dapat disintesis dalam tubuh dan harus diamankan diluar sebagai bagian dari diet
Jawaban permasalahan no. 1 :
BalasHapusKetika dua asam amino diposisikan sedemikian rupa sehingga gugus karboksil daris suatu asam amino berdekatan dengan gugus amino dari asam amino yang lain, suatu enzim akan dapat menyatukan kedua asam amino tersebut melalui reaksi dehidrasi. Ikatan kovalen yang dihasilkannya disebut ikatan peptide. Jika dilakukan berulang-ulang, proses ini akan menghasilkan polipeptida, suatu polimer yang terdiri dari banyak asam amino yang berikatan melalui ikatan peptide. Pada salah satu ujung rantai polipeptida itu terdapat gugus amino bebas, dan pada jung yang berlawanan terdapat satu gugus karboksil bebas. Dengan demikian, rantai tersebut memiliki polaritas, dengan ujung amino (atau terminal N) dan ujung karboksil (terminal C).
Saya akan menjawab permasalahan nomor 3.
BalasHapusPada struktur sekunder β-pleated terbentuk melalui ikatan hidrogen antara daerah linear rantai polipeptida. β-pleated ditemukan dua macam bentuk, yakni antipararel dan pararel. Keduanya berbeda dalam hal pola ikatan hidrogennya. Pada bentuk konformasi antipararel memiliki konformasi ikatan sebesar 7 Å, sementara konformasi pada bentuk pararel lebih pendek yaitu 6,5 Å (Lehninger et al, 2004). Jika ikatan hidrogen ini dapat terbentuk antara dua rantai polipeptida yang terpisah atau antara dua daerah pada sebuah rantai tunggal yang melipat sendiri yang melibatkan empat struktur asam amino, maka dikenal dengan istilah β